(この記事は5/17にリライトされました)
どうも、ろいどです。
3月はアッヴィ【ABBV】を11株購入しました!!
単価は手数料込みで80.3ドルです
配当利回りは5.4%!
さてS&P500は好調ですが【ABBV】は株価が低迷しています
去年の高値の116ドルから30%下落しているのです!
これは好調だった売上のヒュミラのバイオシミラーが進行し米国外での収益が15%落ちたためです
今回はそんなアッヴィの現状とこれからをテーマに書いていきます。
目次
アッヴィは新薬を開発するバイオ製薬会社
アッヴィの専門分野は
- 自己免疫疾患
- がん
- C型慢性肝炎
- ウィルス感染
- 神経変性疾患
を得意とし治療を大きく向上させるというミッションを持つ企業です
アッヴィは2013年にアボット・ラボラトリーズという会社からスピンオフされました
理由の一つとして会社のアッヴィの売上の約60%に相当するヒュミラという製品の特許切れによる株価の下落を守りたかったからです。
しかしヒュミラは2016年に特許切れを起こしていますが売上は堅調に伸ばしています。
収益は65%が米国内、35%が米国外となっています
2018年の業績
アッヴィのプレスリリースを参考にまとめていきます
- EPSは7.91ドル
- 全製品の売上高は営業ベースで327億3300ドル
- ヒュミラの全世界の売上は199億ドルで7.4%の増加
- 血液腫瘍領域のイムブルビカの売上は35億9000ドルで39.5%の増加
- HCVの売上は36億ドル
- 2018年の第四四半期では米国外でのバイオシミラー発売の影響により営業ベースで14.8%減少
- 2016年のstemcentrx社の買収に関する無形資産の減損損失を計上
- 2019のEPS見通しは8.65~8.75ドルとみている
ヒュミラのリスクとこれから
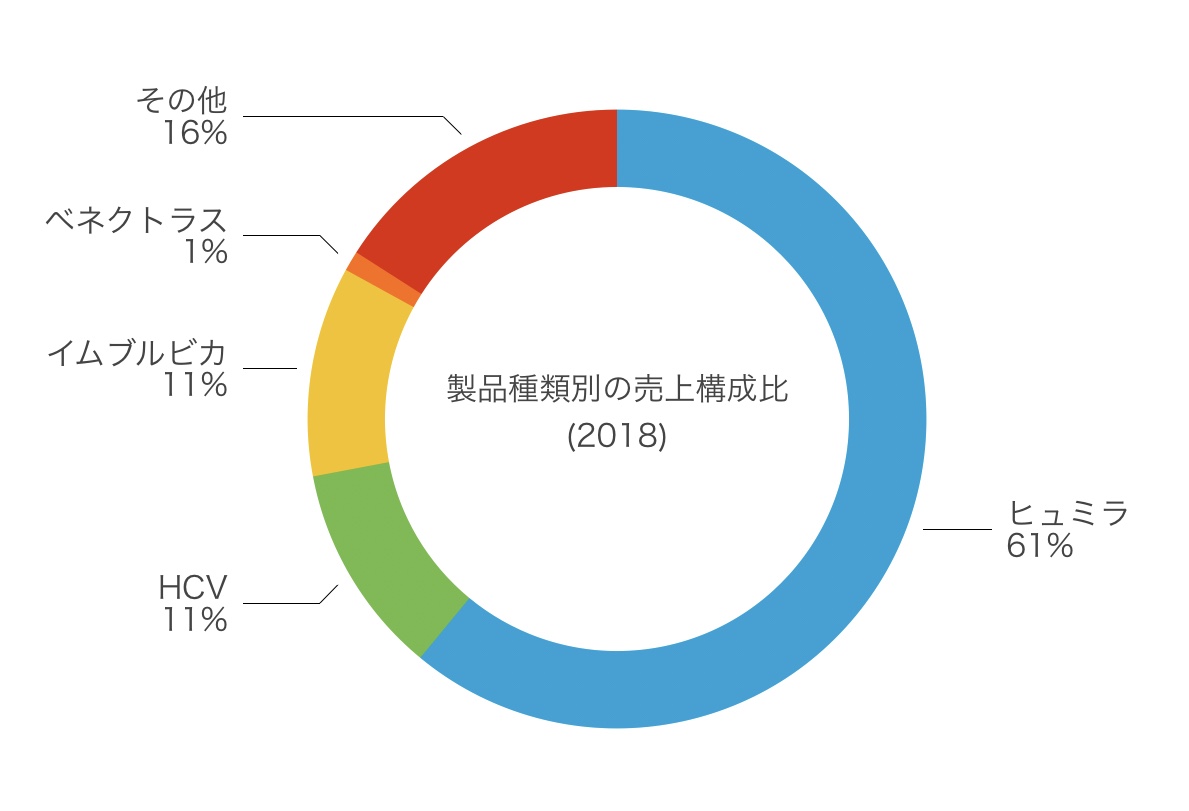
ヒュミラはアッヴィの売上の約6割を占めます。
ヒュミラは2016年に特許切れを起こしていて競合の製品がヒュミラの売上を侵していくことが予想。
WSJによるとヒュミラの売上高は2018年にピークとなり2019から減少し2023に落ち着くとみています。
しかし、米国内では和解交渉により2023年までバイオシミラーの販売させません。
よってヒュミラの売上は2023年まで安泰と言えるでしょう。
また、アニュアルレポートによるとMOMENTA、PFIZERと和解契約を結びアダリムマブ商品(ヒュミラのバイオシミラー)は2023年11月20日からHUMIRAのライセンスを使用するために一定期間abbiveに使用料を支払わなくてはなりません。
また、ヒュミラの特許が切れたことによりヒュミラの開発者にライセンス料を払わなくてもよくなるため、売上高減少は利益率の上昇で部分的に相殺されます。
以上のことを考慮すると、Abbvieはヒュミラの売上は減少するもののお先真っ暗ではない状態だと考えます。
さらにアッヴィはヒュミラの売上減少を補填するために有望なパイプライン(新薬)を備えています。
ヒュミラの穴を埋める新製品
イムブルビカ
血液腫瘍領域の売上は前年比45.9%増でした
特にイムブルビカの売上高は39.5%増で売上の増加率が凄まじいです
とはいっても35億9000万ドルなので199億ドルのヒュミラには及びませんがこれからの成長に期待したいところです
リサンキズマブ
開発中の化合物。
リサンキズマブはインターロイキン(IL-23)を選択的に阻害するように設計された開発中の人化免疫グロブリンG1(IgG1)モノクローナル抗体です。
IL-23は炎症過程に関わる重要な物質で数多くの慢性免疫関連疾患に関係していると考えられています。
要はリサンキズマブは炎症を抑える効果をもつ化合物のことです。
2019年3月1日のプレスリリースで、欧州CHMP(医薬品委員会)の承認勧告を得られたことを発表しました。このことは科学的に製造販売して大丈夫ですよという承認です。
この後、欧州委員会(EC)が審査を審議し決定が下します。
この決定はEUの加盟国、アイスランド、リヒテンシュタイン、ノルウェーで有効となり販売ができるようになります。
欧州委員会決定はCHMPのお墨付きをもらってから67日以内に明らかになります。
リサンキズマブが市場に出回る確率はグンと高くなったと言えます。
(2019/05/17追記)
2019年5月17日のプレスリリースによると、欧州委員会から尋常性乾癬の治療薬としてスキリージ(リサンキズマブ)が承認。
今回の承認で欧州連盟の全加盟国で販売が可能となりました。
- アイスランド
- リヒテンシュタイン
- ノルウェー
の3カ国となります。
(2019/05/17追記)
2019/04/23のアッヴィ社が発表したプレスリリース
「中程度から重度の尋常性乾癬に対する治療薬としてスキリージ(リサンキズマブ)のFDA承認にされたことを発表しました。
スキリージは5月初旬に米国で発売予定とのこと。
(2019/04/15追記)
2019年3月26日のアッヴィのプレスリリースによるとスキリージ(リサンキズマブ)が日本で治療薬として承認されました。
治療薬としての承認は世界初とのこと。
リサンキズマブが直す複数タイプの乾癬の患者さんは日本に約40万人と言われていて、世界的に見ると約一億人いるようです。
多くの患者を助け、キャッシュを創出する薬になることが現実的になってきています。
スキリージはFDAでも現在審査中で、2019年前半にFDAの判断が得られる見通しのよう。
スキリージがどうなるのか今年は目を配っていきたいところ。
ウパダシチニブ
こちらも開発中の化合物。
ウパダシチニブは重度の関節リウマチおよびその他の免疫関連治療薬として期待されている化合物です。
2019年2月19日のプレスリリースではSELECT第Ⅲ相プログラムに基づく新薬承認申請(NDA)について優先審査指定を受けました。
2019年3四半期の規制当局による承認を見込んでいるとのことです。
また、ウパダシチニブは欧州での医薬承認申請を受けており米国と欧州で承認が許可さで販売が行われることで新たなキャッシュを生み出すことが期待できます。
アッヴィの今後
- 営業利益率は40%と高く潤沢なキャッシュを期待できる
- バイオシミラーの懸念点はあるが積極的な増配と自社株買い、買収で株価は下支えられる
- イムブルビカの成長に注目
- 審査に段階が終盤まで来ているリサンキズマブとウパダシチニブの今後に注目
(2019年4月の段階ではリサンキズマブは日本で治療薬に承認を取得)
ヒュミラに頼っていた売上は徐々に改善されつつあり2016年の90%近い売り上げから59%まで売上割合を落としています。
ヒュミラの売り上げが伸びているにも関わらずです。
これは経営陣がヒュミラに頼らず売上を上げることに尽力しており成果が出てきていることを示しています。
これからも頑張ってほしい所ですね!
特許の損失や新薬が承認を得られなかったなど、ヘルスケアセクターの個別株はリスクが高いです。
投資の際は自己責任でお願い致します!
それでは!
ろいど
ウパダシニチブって言いにくいし覚えづらい・・・
















コメントを残す